文章信息
文章题目:Molecular basis of RADAR anti-phage supramolecular assemblies
期刊:Cell
发表时间:2023年2月9日
主要内容:中科院生物物理研究所高璞团队在Cell杂志上发表题为Molecular basis of RADAR anti-phage supramolecular assemblies的文章,该研究发现了RADAR不同组分间的互作关系,揭示了其通过形成新型超分子复合体来实现RNA装载、运输和脱氨修饰的偶联机制。
原文链接:https://doi.org/10.1016/j.cell.2023.01.026
使用TransGen产品:Trans10 Chemically Competent Cell(CD101)

研究背景
在宿主细胞和病毒的漫长斗争中,宿主细胞逐渐形成多种免疫机制来抵抗病毒感染,其中,针对核酸分子的免疫识别和操作扮演着极为重要的角色,这种机制广泛存在于从细菌到哺乳动物等几乎所有的免疫系统中。细菌的信号转导和调控机制相较于哺乳动物更为简单高效,其编码的多种抗病毒免疫系统可直接对核酸分子进行切割或修饰,因此细菌免疫系统被广泛用于多种生物学工具的开发。
此前,Feng Zhang和Eugene Koonin团队发现了一种拥有全新核酸修饰活性的细菌免疫系统:RADAR(phage restriction by an adenosine deaminase acting on RNA),是目前已知的唯一可过催化RNA的A-to-I(adenosine-to-inosine)脱氨来执行抗病毒功能的细菌防御系统,它包含RdrA(ATPase酶活性)和RdrB(腺苷脱氨酶活性)两种核心组分。病毒感染宿主后RADAR被激活,进而广泛催化宿主及病毒的转录组RNA脱氨,使感染细胞死亡,进而阻断病毒传播。RADAR在抗病毒免疫和RNA修饰方面展现出多种优势,但目前关于RADAR的研究还不十分清楚,很多问题亟需解决。
文章概述
研究人员首先解析了RdrB和RdrA的结构,发现12个RdrB按照特定的方式组装成笼状结构,功能实验表明RdrB亚基间的互作对抗病毒功能至关重要。RdrA同时组装成单层的7聚体环和由两个7聚体环叠合而成的双层14聚体环,RdrA环中心的直径和表面电荷均符合底物RNA的特点,进一步的生化实验表明RdrA环与Stem-Loop RNA存在特异性结合,且RNA的存在可显著促进RdrA的ATPase酶活性。接着,研究人员通过解析RdrA与Stem-Loop RNA复合物的结构,发现了RNA装载到RdrA环的动态底部的构象并发现RNA的装载与ATP的结合存在关系。最后,通过生化实验确定RdrB和RdrA存在互作,互作的分子机制是RdrA的7聚体环通过其结构稳定的顶部与RdrB笼进行对接,且RdrA环的底物运输通道恰好与RdrB的活性中心完美对齐,从而实现了底物装载、运输和修饰的巧妙偶联。此外,研究人员还发现RdrB及RdrA-RdrB复合物也可以催化多种小分子代谢类底物(ATP/dATP/ADP/dADP/AMP/dAMP/ adenosine)的脱氨反应。已有研究表明细胞内的小分子类inosine大量聚集,也会对细胞产生毒性并使其生长停滞。因此,RADAR对RNA类底物和小分子类底物的脱氨修饰,可能共同推动了其有效的抗病毒功能。
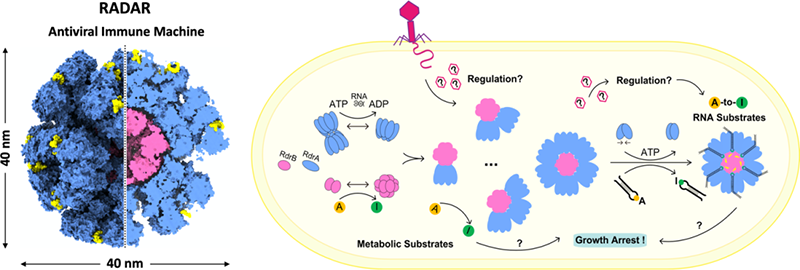
RADAR超分子复合体的组装和工作机制
该研究报道了RADAR系统超分子复合体的组装细节,发现了RADAR系统实现底物装载、运输及修饰的多酶偶联机制,对开发基于RADAR的base-editing工具、纳米颗粒载体和新型抗菌疗法等提供了基础。
全式金产品支撑
优质的试剂是科学研究的利器。全式金感受态细胞Trans10 Chemically Competent Cell(CD101)助力本次研究。
Trans10 Chemically Competent Cell(CD101)
Trans10感受态细胞经特殊工艺制作,与传统制备的感受态细胞相比,具有更高的转化效率。适用于高效的DNA克隆和质粒扩增,能保证高拷贝质粒的稳定复制。
● 具有硫酸链霉素抗性(StrR)
● 适用于毒基因克隆和质粒DNA的稳定复制
● 适用于蓝白斑筛选
● 转化效率高达108 cfu/μg DNA以上
全式金产品再一次登上Cell期刊,是大家对全式金产品和服务的认可,也完美诠释了全式金一直以来秉承的“品质高于一切,精品服务客户”的理念。希望全式金未来能与更多的科研工作者并肩奋斗,用更多更好的产品持续助力科研。
使用Trans10 Chemically Competent Cell(CD101)产品发表的部分文章:
● Gao Y N, Luo X, Li P P, et al. Molecular basis of RADAR anti-phage supramolecular assemblies [J].Cell,2023.
● Huang S H, Liu J, Zhou J, et al. Identification and characterization of a pyridoxal 5′-phosphate phosphatase in tobacco plants [J]. Plant Science,2019.
● Zhong S J, Zhang S, Fan X Y, et al. A single-cell RNA-seq survey of the developmental landscape of the human prefrontal cortex [J].Nature,2018.
● Kong B J, Cao Y, Wu D N, et al. Affinity maturation of an antibody for the UV-induced DNA lesions 6,4 pyrimidine-pyrimidones [J].Applied Microbiology and Biotechnology,2018.
● Chen X Y, Xu F, Zhu C M, et al. Dual sgRNA-directed gene knockout using CRISPR/Cas9 technology in Caenorhabditis elegans[J].Cell,2014.





