文章信息
文章题目:Regulatory mechanisms of strigolactone perception in rice
期刊:Cell
发表时间:2024年11 月4日
主要内容:中国科学院遗传与发育生物学研究所李家洋团队青年研究员王冰等人,在Cell杂志上发表了文章Regulatory mechanisms of strigolactone perception in
rice,该研究发现了植物激素独脚金内酯信号感知机制及其在氮素响应中的关键作用,阐明了植物如何通过调控独脚金内酯信号感受途径中的“油门”和“刹车”,“聪明灵活”地调控不同环境中独脚金内酯信号感受的持续时间和信号强度,进而改变植物株型。
原文链接:https://doi.org/10.1016/j.cell.2024.10.009
使用TransGen产品:
Trans5α Chemically Competent Cell (CD201)
BL21(DE3) Chemically Competent Cell (CD601)

研究背景
独脚金内酯是近年来发现的一种重要植物激素,在调控植物分枝(即分蘖)数目这种生长发育关键性状中发挥关键作用。在独脚金内酯信号转导领域,植物细胞如何感受独脚金内酯一直是该研究领域的前沿和难点,科学家对信号感知机制存在争议。
文章概述
首先,该研究团队系统分析了在D14与D3、D53蛋白相互作用中发挥重要功能的氨基酸位点,进而基于生化和遗传数据,揭示了独脚金内酯信号感受模型,即D3具有两种拓扑构象。
在解析独脚金内酯信号启动机制的基础上,研究人员进一步分析了独脚金内酯信号感受的终止机制。通过实验发现D14的泛素化和蛋白降解依赖于D14与D3的直接相互作用,并且需要D14蛋白通过N端的无序结构域(N-terminal disordered domain, NTD)与26S蛋白酶体直接相互作用。
D3作为E3连接酶中识别底物的亚基,首先促使D53泛素化和降解来启动信号转导,随后促使D14发生泛素化和降解来终止信号感受。这就构成了植物细胞中信号转导的一对“油门”和“刹车”,能够精确地调控独脚金内酯信号感受的持续时间和信号强度。
更为有趣的是,D14的NTD结构域可以被磷酸化修饰,抑制D14的泛素化修饰和蛋白降解,进而调控水稻的分蘖发育。低氮环境增强了D14的磷酸化修饰进而抑制蛋白降解,增强独脚金内酯信号感受。遗传分析进一步证明了D14在N端的磷酸化是低氮信号调控水稻分蘖的重要机制。对D14的磷酸化位点进行精准改良,能够显著降低水稻分蘖对氮肥的依赖性,实现“减氮肥少减分蘖”甚至“减氮肥不减分蘖”。
结合已有研究结果,研究者提出低氮环境一方面通过诱导独脚金内酯合成增强信号感知,另一方面通过促进D14的磷酸化抑制蛋白降解,进而降低独脚金内酯信号感受的终止。两种机制协同增强了独脚金内酯途径的功能,实现对分蘖数目的抑制。
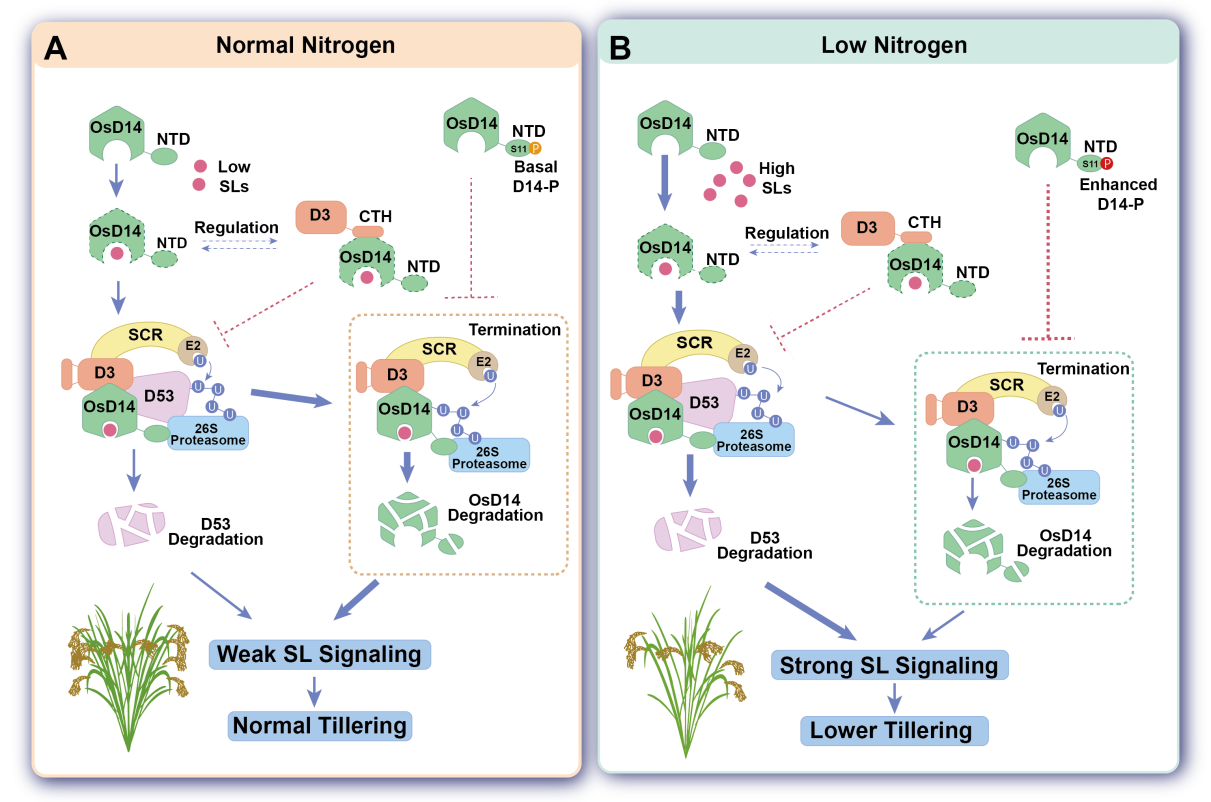
水稻独脚金内酯信号感受及其在低氮中的作用模型
(A)D14作为独脚金内酯受体发挥作用,并与D3形成复合物,D3通过改变其CTH基序显示出两种拓扑构象。D14和Engaged CTH构象D3之间的相互作用触发D53的泛素化和降解,以启动SL信号转导并抑制分蘖。具有dislodged CTH构象D3可能会使D14处于“迟钝”状态,以减弱SL感知并抑制D53降解。D53降解后,D14被SCFD3复合物进一步泛素化,并以NTD依赖的方式降解,导致独脚金内酯信号感受的终止。D14磷酸化主要发生NTD结构域,以抑制其自身的泛素化和降解。
(B)低氮增强D14磷酸化以稳定D14,导致独脚金内酯信号感受延迟终止。低氮也会提高独脚金内酯生物合成以增强信号感受。这些机制协同确保了强烈的独脚金内酯信号转导并抑制分蘖发育,从而调节了低氮的发育可塑性。
综上所述,该研究成果阐明了水稻中由独脚金内酯受体D14介导的信号感知的激活、调控和终止机制,解决了独脚金内酯信号感知机制的争议问题,发现了在泛素化修饰和蛋白降解之间新的调控机制,揭示了D14通过磷酸化调控自身稳定性的新机制以及该机制在水稻分蘖响应低氮环境中的核心作用。通过改变D14的磷酸化状态能够实现降低氮肥投入而不减少分蘖,对作物株型的精准改良以及减肥增产水稻新品种的分子设计育种具有重要指导意义。
全式金生物产品支撑
优质的试剂是科学研究的利器。全式金生物的克隆感受态细胞Trans5α Chemically Competent Cell (CD201)和表达感受态细胞BL21(DE3) Chemically Competent Cell (CD601)助力本研究。
Trans5α Chemically Competent Cell (CD201)
本产品经特殊工艺制作,可用于DNA的化学转化。使用pUC19质粒DNA检测,转化效率高达108 cfu/µg DNA以上,自上市以来多次荣登Cell、Nature等知名期刊,助力科学研究。
产品特点:
• 用于蓝白斑筛选。
• recA1和endA1的突变有利于克隆DNA的稳定和高纯度质粒DNA的提取。
BL21(DE3) Chemically Competent Cell (CD601)
本产品经特殊工艺制作,可用于DNA的化学转化。使用pUC19质粒DNA检测,转化效率高达107 cfu/μg DNA。使用Control Plasmid I (Amp+ )用于检测细胞是否具有表达功能,表达蛋白大小为25 kDa。自上市以来多次荣登Cell等知名期刊,助力科学研究。
产品特点:
• 该菌株用于T7 RNA 聚合酶为表达系统的高效外源基因的蛋白表达宿主,T7噬菌体RNA聚合酶基因的表达受控于λ噬菌体DE3区的lacUV5启动子,该区整合于BL21的染色体上。该菌株适合于非毒性蛋白的表达。
全式金生物产品再一次登上Cell期刊,证明了大家对全式金生物产品品质和实力的认可,也完美诠释了全式金生物一直以来秉承的“品质高于一切,精品服务客户”的理念。全式金生物始终在助力科研的道路上砥砺前行,希望未来能与更多的科研工作者并肩奋斗,用更多更好的产品持续助力科研。
使用Trans5α Chemically Competent Cell (CD201)产品发表的部分文章:
• Hu Q L, Liu H H, He Y J, et al. Regulatory mechanisms of strigolactone perception in rice [J]. Cell, 2024.
• Shang P, Rong N, Jiang J J, et al. Structural and signaling mechanisms of TAAR1 enabled preferential agonist design[J]. Cell, 2023.
• Zhong S, Ding W, Sun L, et al. Decoding the development of the human hippocampus[J]. Nature, 2020.
• Jiang L, Xie X, Su N, et al. Large Stokes shift fluorescent RNAs for dual-emission fluorescence and bioluminescence imaging in live cells[J]. Nature Methods, 2023.
• Li X, Zhang Y, Xu L, et al. Ultrasensitive sensors reveal the spatiotemporal landscape of lactate metabolism in physiology and disease[J]. Cell Metabolism, 2023.
• Han W, Gao B Q, Zhu J, et al. Design and application of the transformer base editor in mammalian cells and mice[J]. Nature Protocols, 2023.
• Liu R, Yao J, Zhou S, et al. Spatiotemporal control of RNA metabolism and CRISPR–Cas functions using engineered photoswitchable RNA-binding proteins[J]. Nature Protocols, 2023.
使用BL21(DE3) Chemically Competent Cell (CD601)产品发表的部分文章:
• Hu Q L, Liu H H, He Y J, et al. Regulatory mechanisms of strigolactone perception in rice [J]. Cell, 2024.
• Li H, Zhang Y, Rao G, et al. Rift Valley fever virus coordinates the assembly of a programmable E3 ligase to promote viral replication[J]. Cell, 2024.
• Lu P, Cheng Y, Xue L, et al. Selective degradation of multimeric proteins by TRIM21-based molecular glue and PROTAC degraders[J]. Cell, 2024.
• Lan Z, Song Z, Wang Z, et al. Antagonistic RALF peptides control an intergeneric hybridization barrier on Brassicaceae stigmas[J]. Cell, 2023.
• Medina-Puche L, Tan H, Dogra V, et al. A defense pathway linking plasma membrane and chloroplasts and co-opted by pathogens[J]. Cell, 2020.
• Wang X, Xuan Y, Han Y, et al. Regulation of HIV-1 Gag-Pol expression by shiftless, an inhibitor of programmed-1 ribosomal frameshifting[J]. Cell, 2019.
Zhu G, Wang S, Huang Z, et al. Rewiring of the fruit metabolome in tomato breeding[J]. Cell, 2018.
• Li X, Zhang Y, Xu L, et al. Ultrasensitive sensors reveal the spatiotemporal landscape of lactate metabolism in physiology and disease[J]. Cell Metabolism, 2023.





